
2024-02-28
文章题目:Hyodeoxycholic acid alleviates non-alcoholic fatty liver disease through modulating the gut-liver axis
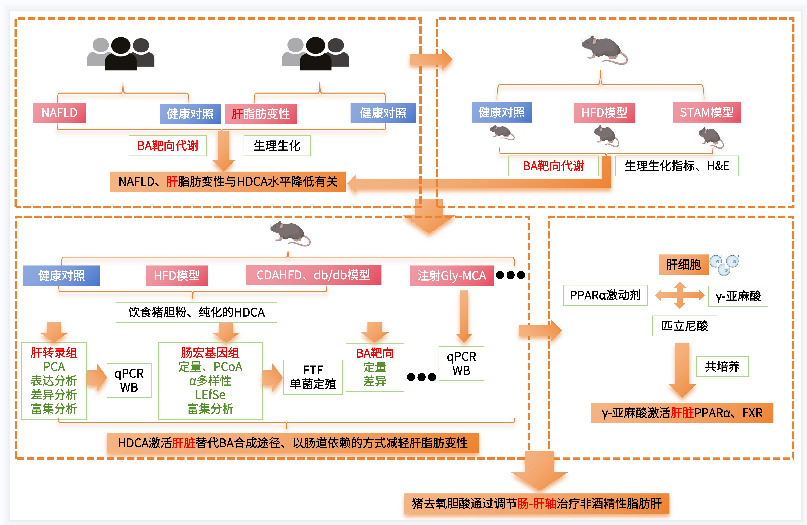
技术手段:转录组、宏基因组、胆汁酸靶向代谢组
上海交通大学医学院附属第六人民医院在《Cell Metabolism》上发表了猪去氧胆酸通过调节肠-肝轴治疗非酒精性脂肪肝的研究成果。本研究的宏基因组、转录组测序和部分数据分析工作由云顶国际亚洲唯一官网生物科技股份有限公司完成。
研究背景
非酒精性脂肪性肝病(NAFLD)被认为是一种影响全球约四分之一人口的流行病。但驱动NAFLD发生和发展的病因和病理因素尚未完全阐明。此外,尚未有抗NAFLD药物得到国际权威机构的批准。胆汁酸(BAs)是一组由肝细胞内胆固醇合成的两亲性分子,BA-肠道菌群串扰与包括NAFLD在内的代谢性疾病有关,在调节宿主葡萄糖和脂质代谢中起重要作用。前期研究显示非12α-羟基化胆汁酸、猪胆酸(HCA)和猪脱氧胆酸(HDCA)在调节葡萄糖稳态和预测2型糖尿病未来风险方面具有治疗潜力。因此我们假设了一种药物治疗策略,通过靶向替代BA合成通路来治疗代谢性疾病。
技术路线
研究结果
1、NAFLD与血清HCA和HDCA水平降低有关
178个NAFLD患者和73个健康对照的BAs谱结果显示,随着NAS的增加,NAFLD个体中HCA与TBA的比值逐渐降低(图1B)。NAFLD患者的HCA+GHCA/TBA和HDCA+GHDCA/TBA比值明显低于健康对照组(图1C )。HCA species/TBA和HDCA+GHDCA/TBA与NAS呈负相关(图1D)。以及合并2型糖尿病(T2DM)-NAFLD患者的HCA与TBA的比值比非T2DM-NAFLD的低(图1E)。
另一个队列与队列1一致,208个健康组和312个肝脂肪变性患者的BAs谱结果显示,肝脂肪变性组中HCA与TBA的比值低于健康组(图1G)。Spearman相关分析显示,HCA与TBA、HCA+GHCA与TBA、HDCA+GHDCA与TBA的比值与HSI、血清总胆固醇(TC)、TG呈负相关(图1H )。这些数据表明NAFLD患者具有独特的代谢表型,其特征是血清中HCA species水平显著降低,特别是HDCA + GHDCA。
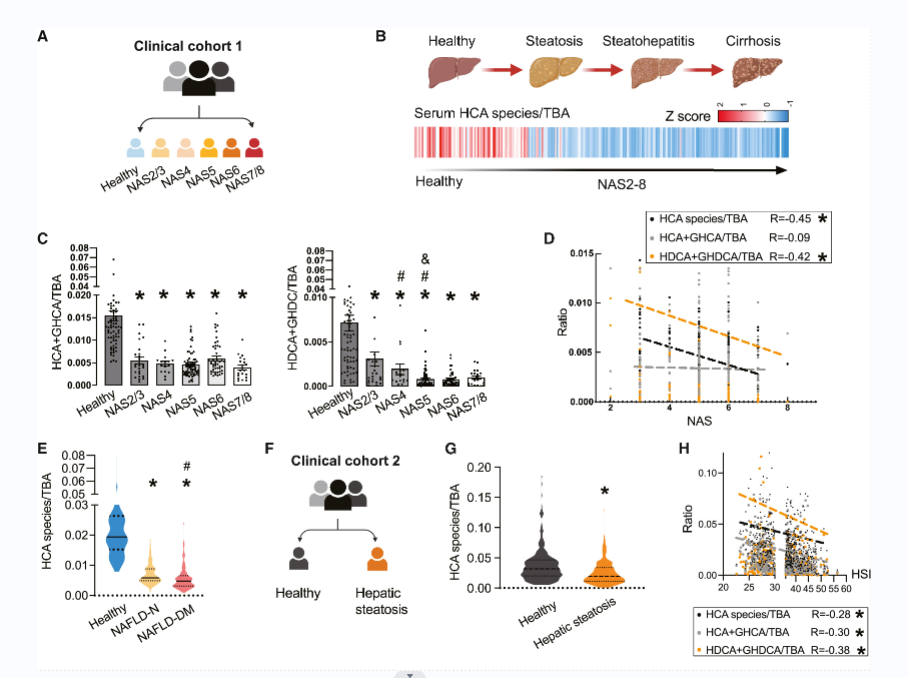
图1(A-H) 在NAFLD患者和hfd诱导的NAFLD小鼠的HCA种类减少
2、小鼠模型的肝脂肪变性与HDCA水平降低有关
在长期HFD小鼠模型中,随着HFD饲喂时间的延长,HFD模型的HCA的浓度逐渐降低,尤其是HDCA + THDCA(图1J)。STAM小鼠模型模拟了人类NAFLD的肝脏变化,在NAFLD进展的不同阶段,HDCA + THDCA浓度显著低于对照组(图1L)。
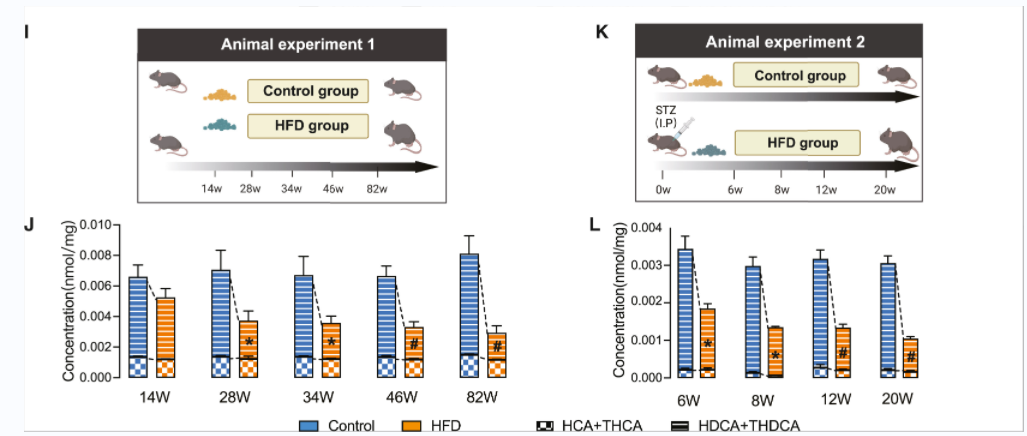
图1(I-K) 在NAFLD患者和hfd诱导的NAFLD小鼠的HCA种类减少
3、HDCA减轻了NAFLD表型
HFD喂养的弥漫性肝脂肪变性小鼠分别给予猪胆粉或纯化的HDCA 8周(图2A)。结果显示,猪胆粉和HDCA显著降低了肝细胞内积聚的多余脂滴(图2B和2C)和肝脏重量(图2D)。HFD+HDCA组和HFD+猪胆粉组血清ALT水平显著降低(图2E)。干预组肝脏TG浓度降低(图2F)。CDAHFD和db/db小鼠模型给予HDCA治疗后肝脏TG、组织学评估(脂肪变性、气球样变、炎症和纤维化评分)和血清ALT显著改善(图2H-2M)。
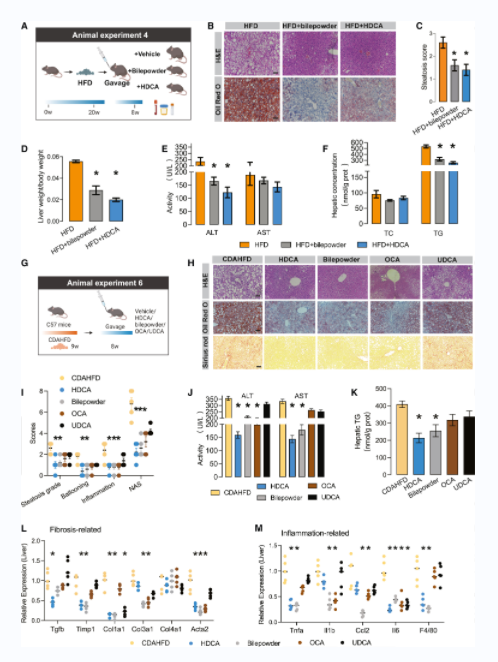
图2 HDCA减弱了nafld相关的代谢表型
4、HDCA激活肝脏替代BA合成途径
对照组、HFD组、HFD+猪胆粉组和HFD+HDCA组的肝脏组织RNA测序分析结果显示,对照组、HFD +猪胆粉和HFD + HDCA组聚在一起(图3A),Cyp7b1显著上调,Cyp7a1显著下调(图3C)。KEGG分析发现原发性胆汁酸生物合成通路受到显著影响(图3B)。表明BA生物合成过程在HDCA干预下从经典途径转向替代途径(图3D)。qPCR和WB证实了转录组的结果,即CYP7A1表达下调,CYP7B1表达上调(图3E、3F)。
肝脏Cyp7b1敲低/敲除结果显示,HDCA或猪胆粉对shCyp7b1小鼠的治疗作用受损(图3H-3I)。肝脏Cyp7b1过表达时,肝脏中脂肪堆积已经大大减少(图3K)。这些结果表明,CYP7B1驱动的BA替代合成途径在减轻肝脏脂肪变性中起着至关重要的作用,可能是HDCA抗NAFLD作用的关键机制。
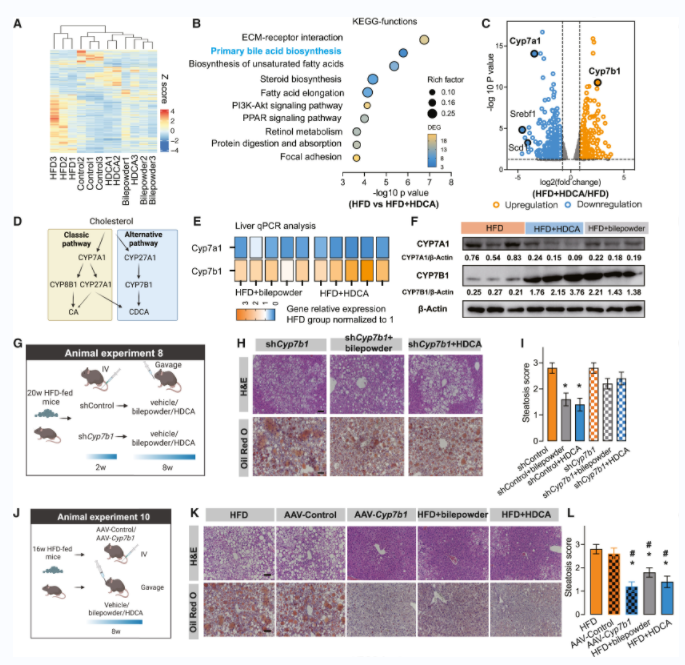
图3 HDCA激活BA替代合成途径,以CYP7B1为关键靶点
5、HDCA以肠道依赖的方式减轻肝脂肪变性
从肠道基因、蛋白、血清FGF15水平(图4A-4C)和FXR免疫染色可以看出,HDCA或猪胆粉对不同模型小鼠肠道FXR-FGF15信号传导均有抑制作用(图4D-4E)。用肠道限制性FXR抑制剂甘氨酸-b-胆酸(Gly-MCA)模拟HDCA对肠道FXR信号的影响后,发现肝脏CYP7A1和CYP7B1均上调(图4F-4H),这表明还有其他因素导致BA合成途径的改变。粪便移植实验(FMT)结果表明。与FMT-HFD组相比,接受HFD+HDCA组粪便的小鼠肝脏脂肪积累减少(图4J),葡萄糖稳态状态得到改善(图4L)。这证实了肠道微生物群在HDCA对肝脂肪变性的治疗作用中的关键作用。
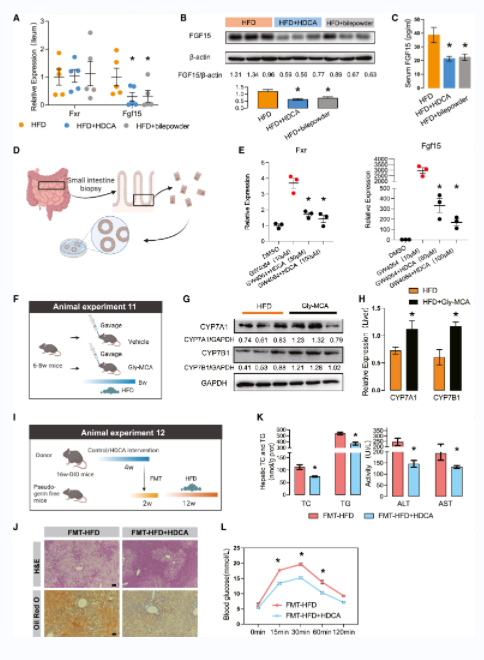
图4 HDCA以肠道依赖的方式减轻肝脂肪变性
6 狄氏副拟杆菌介导的肝PPARα活化下调了CYP7A1
HFD、HFD+猪胆粉和HFD+HDCA组盲肠内容物宏基因组测序结果显示,HFD和猪胆粉、HDCA治疗组之间肠道微生物群落聚类明显(图5A);在门水平上,猪胆粉和HDCA处理后厚壁菌门显著减少,拟杆菌门显著增加(图5B);拟杆菌门的狄氏副拟杆菌(P. distasonis)差异显著,在处理组急剧增加(图5C-5D);不饱和脂肪酸途径的生物合成明显增加(图5G)。生长曲线分析显示,HDCA比CA和CDCA更能促进P. distasonis的生长(图5E)。P. distasonis单菌定殖实验结果显示,HFD+活菌组脂肪堆积程度明显减轻(图5F),肝脏CYP7B1表达升高,CYP7A1表达降低。定量代谢物分析显示,单菌定殖后不饱和脂肪酸,尤其是γ-亚麻酸(C18:3)显著增加(图5H-5I)。此外,相比对照饮食,在HFD提取物中培养P. distasonis时,P. distasonis在很短的时间内会产生γ-亚麻酸(C18:3)(图5J)。
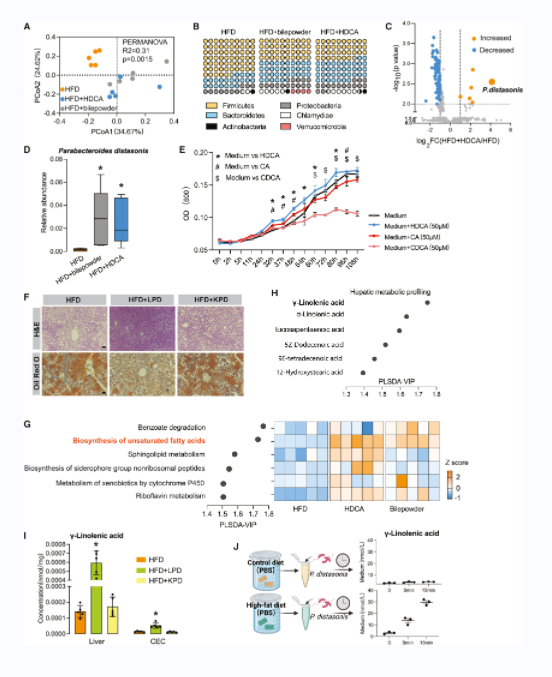
图5 HDCA富集了异裂副杆菌及其衍生的脂肪酸
转录组结果显示,PPAR信号通路被显著上调(图6A)。原代小鼠肝细胞、PPARα激动剂、匹立尼酸和梯度浓度的γ-亚麻酸共培养结果显示CYP7A1被抑制(图6B)。PPARα/RXRα的过表达也降低了CYP7A1荧光素酶的活性,在293T细胞中添加匹立尼酸和γ-亚麻酸后,这种活性进一步降低(图6C)。HFD喂养Pparα-/-小鼠12周后,HDCA和P. distasonis并没有显著改善这些小鼠的脂肪肝表型(图6D-6H)。此外,当原代肝细胞与PPARα激动剂和低剂量FGF19共培养时,CYP7A1被抑制(图6I)。考虑到PPARα与FXR之间的分子联系,PPARα激动剂治疗原代肝细胞后,观察到FXR表达上调(图6J和6K)。我们认为肝脏PPARα被γ-亚麻酸激活,而γ-亚麻酸又激活了肝脏FXR。
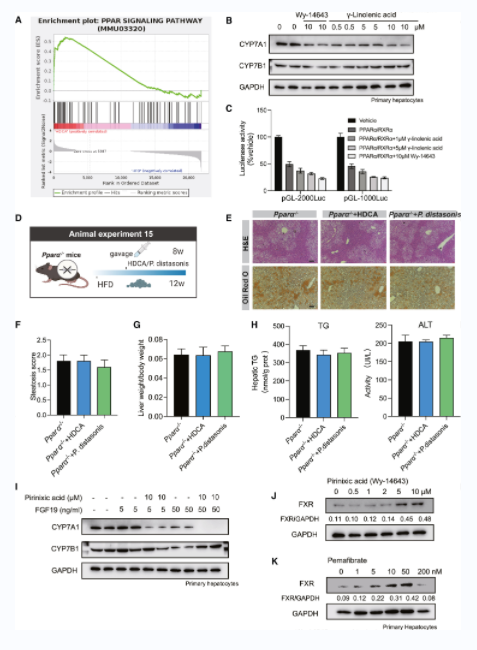
图6 CYP7A1被肠道菌群产生的脂肪酸介导的PPARα激活所抑制
综上所述,HDCA通过抑制肠道FXR并激活以CYP7B1为中心的替代途径,通过P. distasonis -γ-亚麻酸-PPARα信号通路抑制以CYP7A1为中心的经典途径,从而改变了肝脏BA合成途径(图7)。
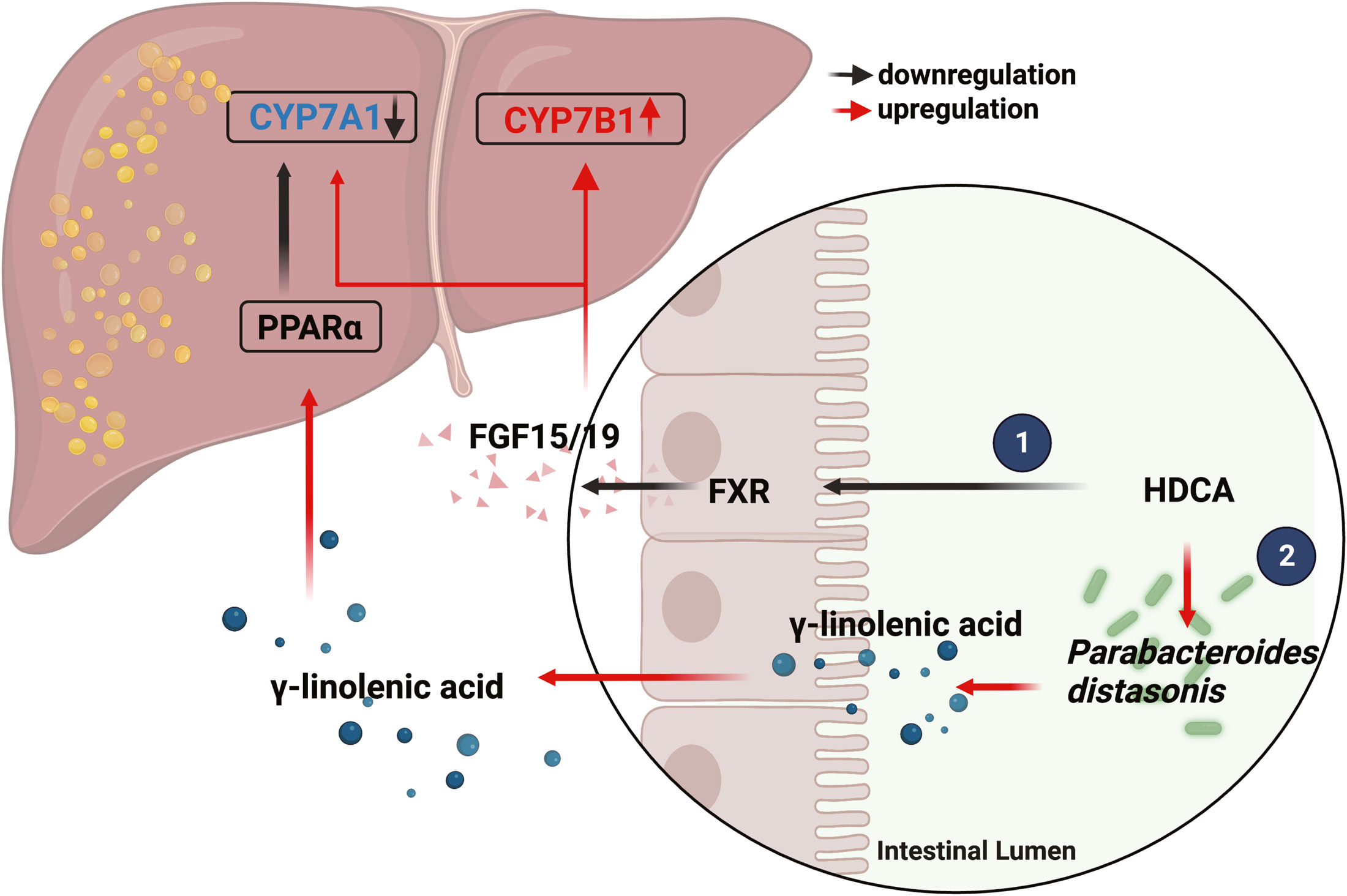
图7 HDCA改善肝脂肪变性的分子机制
结 论
本文研究了一组由肠道微生物群修饰的胆汁酸(BAs),即猪去氧胆酸(HDCA)species,与非酒精性脂肪肝病的存在和严重程度呈负相关。在多种小鼠模型中,HDCA被证实能够通过抑制肠道的法尼酯X受体(FXR)并上调肝脏的CYP7B1来缓解NAFLD。此外,HDCA显著增加了益生菌种类如狄氏副拟杆菌的丰度,这种益生菌通过脂肪酸-肝脏过氧化物酶体增殖物激活受体α(PPARα)信号通路增强脂质分解代谢,进而上调肝脏的FXR。这些发现表明,HDCA具有治疗NAFLD的潜力,其独特机制是同时激活肝脏的CYP7B1和PPARα。
原文索引: Kuang J, Wang J, Li Y, Li M, Zhao M, Ge K, Zheng D, Cheung KCP, Liao B, Wang S, Chen T, Zhang Y, Wang C, Ji G, Chen P, Zhou H, Xie C, Zhao A, Jia W, Zheng X, Jia W. Hyodeoxycholic acid alleviates non-alcoholic fatty liver disease through modulating the gut-liver axis. Cell Metab. 2023 Oct 3;35(10):1752-1766.e8. doi: 10.1016/j.cmet.2023.07.011.